D-amino acids in foods / D-amino acidi nel cibo
Food proteins usually contains L-amino acids but also D-amino acids (D-AAs) are quite spread in foods either naturally originated (like in molluscs or in fermented food) or artificially formed like, i.e. during food processing (under specific conditions such as high temperature or strong alkaline treatments) or foods adulteration [Friedman, 1999]. For a list of foods containing D-AAs see Table 1.
Table 1. Distribution of D-AAs in foods [partially adapted from Zagon et al., 1994].
Table 1
|
Food |
D-AAs |
Relative amount (%) |
|
Milk and milk powder Raw milk |
D-Asp D-Glu D-Ala |
2-3 2-3 3-4 |
|
UTH-milk |
D-Asp D-Glu D-Ala |
2-3 3-5 4-6 |
|
Infant formula |
D-Asp D-Glu D-Ala |
10-12 3-5 2-3 |
|
Milk powder |
D-Asp D-Glu D-Ala |
4-5 3-5 8-12 |
|
Dairy/cheese Yogurt |
D-Asp D-Glu D-Ala |
20.9 12.4 61.3 |
|
Kefir |
D-Asp D-Glu D-Ala D-Leu D-Val D-Lys D-Ser |
17.6 4.9 37.4 22.6 5.6 4.7 3.4 |
|
Sour milk |
D-Asp D-Glu D-Ala D-Leu D-Val D-Lys |
14.1 4.0 38.6 18.4 6.8 3.1 |
|
Gorgonzola |
D-Glu D-Ala D-Leu |
1.5 33.2 0.5 |
|
Emmentaler |
D-Asp D-Glu D-Ala D-Leu D-Pro D-Lys |
2.9 6.2 42.2 1.0 14.7 1.8 |
|
Mozzarella |
D-Phe D-Glu |
<1 2.7 |
|
Parmigiano Reggiano (24 months ripened)
|
D-Asp D-Glu D-Pro D-Ala |
27 15 32 26 |
|
Vegetable juice Carrot |
D-Asp D-Phe D-Glu D-Ala D-Leu D-Val |
0.9 4.9 5.0 13.5 13.8 8.2 |
|
Celery |
D-Asp D-Glu D-Ala |
0.6 0.8 22.1 |
|
Red beet |
D-Asp D-Glu D-Ala D-Leu D-Val |
1.3 1.0 8.2 5.5 1.9 |
|
Fruit juice Apple |
D-Ala |
17 |
|
Grapefruit |
D-Ala |
22-33 |
|
Orange Pears Pineapple |
D-Ala D-Ala D-Ala |
21 10-12 42 |
|
Alcoholic beverages Wheat beer |
D-Asp D-Phe D-Glu D-Ala |
36 0.6 16.2 13.2 |
|
White wine |
D-Asp D-Glu D-Ala D-Leu |
2 0.7 1.2 0.5 |
|
Sake |
D-Asp D-Glu D-Ala |
1.7 1.1 0.6 |
|
Red wine |
D-Asp D-Glu D-Ala D-Pro (starting from 5-years old wines) |
4.1 3.0 3.3 10 |
|
Beer |
D-Asp D-Glu D-Ala |
3.6 1.9 1.1 |
|
Vinegar Rice |
D-Asp D-Ala |
2.7 2.3 |
|
Apple |
D-Asp D-Ala D-Glu D-Asn |
3.5 13.4 2 13.1 |
|
White wine |
D-Ala |
3.3 |
|
Tomato |
D-Asp D-Ala D-Glu D-Asn |
0.4 0.3 0.2 0.5 |
|
Balsamic |
D-Asp D-Ala D-Glu D-Arg |
5.7 3.4 2.4 0.7 |
|
Coffee Instant |
D-Asp D-Glu D-Pro |
43 27.4 14.4 |
|
Roasted |
D-Asp D-Glu D-Phe |
23-38 32-41 9-12 |
|
Green |
D-Glu |
<0.2 |
|
Ham/meat Raw hamburger |
D-Asp D-Phe D-Ala D-Leu D-Val |
6.2 2.8 3.2 3.1 1.6 |
|
Roasted hamburger |
D-Asp D-Phe D-Ala D-Leu D-Val |
5.5 2.7 2.8 3.2 1.5 |
|
Parma ham |
D-Asp D-Glu D-Ala D-Leu D-Val D-Ile D-Pro D-Lys |
5.0 10.8 9.1 7.6 10.9 5.9 4.9 14.6 |
|
Raw ham |
D-Asp D-Phe D-Glu D-Ala |
0.03 0.5 1.0 0.2 |
|
Ham, heated to 180°C |
D-Asp D-Phe D-Ala D-Leu D-Val |
10.7 3.1 2.4 3.1 1.6 |
|
Other products Fermented black beans |
D-Asp D-Ala D-Pro |
7.8 10.6 4.9 |
|
Liquid spice |
D-Asp D-Phe D-Glu D-Ala D-Leu D-Val D-Pro D-Ser |
6.9 3.7 3.0 2.7 10.0 1.5 2.0 1.4 |
|
Toast, roasted |
D-Asp D-Phe D-Ala D-Leu D-Val |
10.5 2.4 2.8 2.7 1.1 |
|
Toast, untreated |
D-Asp D-Phe D-Ala D-Leu D-Val |
5.6 2.3 2.4 3.2 0.9 |
D-amino acids due to technological processes
Food industries prepare increasing quantities of foods (baked potatoes, fruit juices and fruit pulp, breakfast cereals, tomato sauces, milk, etc.) which can contain substantial quantities of D-AAs. In these foods, the racemization process is responsible for the formation of D-AAs. The principal factors influencing racemization are alkaline pHs, treatment duration, heat treatment and duration of heating (frequently too long) [Genchi, 2017].
Milk, meat and some fruit juices, that normally contain low quantities of D-AAs, are often exposed, in the course of preparation for consumption, to conditions promoting the racemization process. Milk and dairy products represent suitable examples of how the composition of natural substances are altered by processing. An investigation performed on amino acids in milk showed that racemization is absent in samples exposed to heat treatments at a high temperature for short duration (such as pasteurization and ultra-high temperature (UHT) processes), while high levels are present in sterilized or powder milk as a consequence of the technological process [Gandolfi, 1994]. In those cases, the amount of D-alanine (D-Ala) increased from 3-4% (the reference concentration which is considered physiological) up to 12%. D-methionine (D-Met) can be chemically modified during food processing and L-phenylalanine (L-Phe) and L-tyrosine (L-Tyr) racemize rapidly to the corresponding D-enantiomer upon alkali or heat treatment [Csapò et al., 2008]. The effect of temperature on D-serine (D-Ser) and D-threonine (D-Thr) content of soybean protein is reported in Fig. 4 of [Friedman, 1999] and the enantiomeric composition of the alkali-treated proteins in Table 2 of the same paper.
For this reason, the presence of D-AAs in food can be used as a biomarker of thermal and alkaline treatments.
D-amino acids in fermented foods
In the case of fermented foods, the presence of D-AAs can be considered “natural”. D-AAs formation in fermented products can arise from the starting materials or could be due to microbial activity during fermentation. High levels of D-Ala, D-Asp and D-Glu are widespread in cheese, yoghurt, wine, vinegar, beer, sake, soy sauce, etc. In wine, beer, and vinegar the presence of D-proline (D-Pro) is used as an indicator for age dating [Chiavaro et al., 1998]. The use of lactic acid bacteria and yeasts in fermentation of sourdough before baking results in the production of free D-Ala and D-Glu in the dough [Gobbetti et al., 1994]. Honey and liquid spices possess variable amounts of free D-AAs [Pawloska and Armstrong, 1994; Friedman, 1999]. Large amounts of D-Ala, D-Asp and D-Glu are also present in long aged cheese such as Parmigiano Reggiano and Grana Padano (up to 5 g/kg). The D-amino acid content varies among cheeses and changes during cheese production and ripening [Marchelli et al., 1997; Innocente and Palla, 1999; Marchelli et al., 2007].
D-amino acids as markers of contamination (in unfermented foods)
The amino acids D-Ala, D-aspartic acid (D-Asp), D-arginine (D-Arg) and D-glutamic acid (D-Glu) are present at low levels in fruits such as apples, grapes and oranges, and also in vegetables such as carrots, tomatoes, cabbages as well as in the corresponding juices [Gandolfi, 1994]. The presence of specific D-AAs (and their relative amount) could be used to differentiate juices from biologically different fruits (as well as for the adulteration or fortification of the products) [Gandolfi, 1994]. Moreover, the amount of those D-AAs could also be employed as an indicator for the bacterial contamination or for the poor quality of the fruit used for juice preparation [Gandolfi, 1994].
D-amino acids taste
D-AAs have sweeter taste compared to L-enantiomers which generally have bitter flavour. In some cases, the sweetening power of D-valine (D-Val), D-phenylalanine (D-Phe) and D-tryptophan (D-Trp) is higher than that of sucrose [Linden and Lorient 1999]. Alitame (l-α-aspartyl-N-(2,2,4,4-tetramethyl-3-thioethanyl)-d-alaninamide) (Figure 1), an artificial dipeptide sweetener containing L-Asp and D-Ala, is of commercial interest because it is about 2000 times sweeter than sucrose, about 10 times sweeter than aspartame, and six times sweeter than saccharin [Chattopahyay et al., 2014].
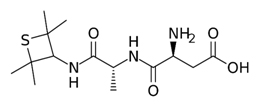
Figure 1: Formula of Alitame
Are D-amino acids good for human health?
The metabolic fate of D-AAs in humans is controversial. In mammals D-AAs degradation occurs via oxidative deamination to ketoacids, catalyzed by D-amino acid oxidase and subsequent transamination to L-amino acids. Whether the human organism is able to fully utilize D-AAs is still unclear, although D-amino acid oxidase is present in human liver and kidneys. Indeed, racemization is restricted to specific amino acids (essentially D-serine) and selected tissues. A main contribution to D-AA metabolism in mammals is provided by microbiota.
Altered levels of D-AAs where reported to induce serious injury especially to kidneys; tissue and blood altered D-AA levels where connected to different pathological states leading to potentially better biomarkers (see “D-AAs in diseases” section) [Marchelli et al., 2007]. Furthermore, D-Ser supplementation is investigated in the treatment of schizophrenia [MacKay et al., 2019].
The nutritional value of D-AAs was largely investigated in mice fed a synthetic all-amino acid diet [Friedman and Levin, 2012]. The biological effects of D-AAs are different whether they are ingested as free amino acids or as components of proteins. The nutritional power of essential D-AAs depends on the amino acid composition, the digestibility and utilization of protein-released amino acids. Actually, peptide bonds with D-L, L-D or D-D configurations are resistant to proteolytic enzymes, thus inducing a reduced digestibility and eventually the formation of oligopeptides with unknown biological activity. No toxic effects were found in trials with parenteral nutrition of adults and children with free D,L-amino acids [Marchelli et al., 2007].
Considering the single D-AA, D-Met is poorly used by humans when consumed orally or in parenteral nutrition, and D-Tyr can significantly decrease growth in mice, as well D-Met and D-Lys [Friedman and Levin, 2012]. Altogether, D-AAs can be used to control body weight because of their specific replacement value (i.e. as the relative concentration of the L-amino acid).
Shiseido company found that the levels of D-Asp decline during aging thus decreasing collagen production. After a trial of 2 months of D-Asp ingestion, the thick of the skin was clearly higher. Based on this finding, the first functional food enriched of D-AAs called “kireinosusume” was produced [Mutaguchi et al., 2016].
References
Chattopadhyay et al. 2014 J. Food. Sci. Technol. 51: 611–621.
Chiavaro et al. 1998 It J Food Sci 10(4): 329-337
Csapò J. et al., 2008 Amino Acids 34(2): 287-292
Friedman M. 1999 J Agr Food Chem 47(9): 3457-3479
Friedman M. and Levin C.E. 2012 Amino Acids 42: 1553-1582
Genchi G. 2017 Amino Acids 49(9): 1521-1533
Gandolfi et al., 1994 J Food Sci 59: 152–154
Gobbetti et al., 1994 J Food Sci 59: 881-884
Innocente N. and Palla G., 1999 J Dairy Res 66: 633-637
Linden G. and Lorient D. 1999 In: New Ingredients in Food Processing: Biochemistry and Agriculture. G. Linden and D. Lorient, ed. CRC Press, pp 184–210
MacKay M.B. et al., 2019 Front Psychiatry 10:25
Marchelli R. et al., 1997 Sc Tecn Latt-Cas 48: 21-32
Marchelli R. et al., 2007 In: D-amino acids: a new frontier in amino acid and protein research. Editors: R. Konno et al., pp 299-315
Mutaguchi Y. et al., 2016 In: D-amino acids. Editors: T. Yoshimura et al., pp 341-357
Pawloska M. and Armstrong D. W., 1994 Chirality 6: 270-276
Zagon J. et al., 1994 Nutr Res 14(3): 445-463
Authors
Giorgia Letizia Marcone – University of Insubria
Elena Crespi – FIIRV (DAAIR Center)
Solitamente le proteine presenti nei cibi sono costituite da L-amino acidi, ma anche gli enantiomeri D- sono largamente diffusi e si possono generare sia naturalmente (come nei molluschi o nei cibi fermentati) che artificialmente, in seguito a processi di trasformazione degli alimenti (ad esempio temperature molto elevate, ambienti fortemente alcalini) o a fenomeni di deterioramento (Friedman, 1999). In Tabella 1 viene riportata una lista di cibi contenenti D-amino acidi (D-AA).
Tabella 1. Distribuzione dei D-amino acidi nei cibi [adattamento da Zagon et al., 1994].
Tabella 1
|
Alimento |
D-AA |
Quantità relativa (%) |
|
Latte e latte in polvere Latte crudo |
D-Asp D-Glu D-Ala |
2-3 2-3 3-4 |
|
Latte UTH |
D-Asp D-Glu D-Ala |
2-3 3-5 4-6 |
|
Latte in formula per bambini |
D-Asp D-Glu D-Ala |
10-12 3-5 2-3 |
|
Latte in polvere |
D-Asp D-Glu D-Ala |
4-5 3-5 8-12 |
|
Latticini/formaggi Yogurt |
D-Asp D-Glu D-Ala |
20.9 12.4 61.3 |
|
Kefir |
D-Asp D-Glu D-Ala D-Leu D-Val D-Lys D-Ser |
17.6 4.9 37.4 22.6 5.6 4.7 3.4 |
|
Latte acido |
D-Asp D-Glu D-Ala D-Leu D-Val D-Lys |
14.1 4.0 38.6 18.4 6.8 3.1 |
|
Gorgonzola |
D-Glu D-Ala D-Leu |
1.5 33.2 0.5 |
|
Emmentaler |
D-Asp D-Glu D-Ala D-Leu D-Pro D-Lys |
2.9 6.2 42.2 1.0 14.7 1.8 |
|
Mozzarella |
D-Phe D-Glu |
<1 2.7 |
|
Parmigiano Reggiano (stagionato 24 mesi)
|
D-Asp D-Glu D-Pro D-Ala |
27 15 32 26 |
|
Succhi di verdura Carota |
D-Asp D-Phe D-Glu D-Ala D-Leu D-Val |
0.9 4.9 5.0 13.5 13.8 8.2 |
|
Sedano |
D-Asp D-Glu D-Ala |
0.6 0.8 22.1 |
|
Barbabietola rossa |
D-Asp D-Glu D-Ala D-Leu D-Val |
1.3 1.0 8.2 5.5 1.9 |
|
Succhi di frutta Mela |
D-Ala |
17 |
|
Pompelmo |
D-Ala |
22-33 |
|
Arancia Pera Ananas |
D-Ala D-Ala D-Ala |
21 10-12 42 |
|
Bevande alcoliche Birra di frumento |
D-Asp D-Phe D-Glu D-Ala |
36 0.6 16.2 13.2 |
|
Vino bianco |
D-Asp D-Glu D-Ala D-Leu |
2 0.7 1.2 0.5 |
|
Sake |
D-Asp D-Glu D-Ala |
1.7 1.1 0.6 |
|
Vino rosso |
D-Asp D-Glu D-Ala D-Pro (starting from 5-years old wines) |
4.1 3.0 3.3 10 |
|
Birra |
D-Asp D-Glu D-Ala |
3.6 1.9 1.1 |
|
Aceto Riso |
D-Asp D-Ala |
2.7 2.3 |
|
Mele |
D-Asp D-Ala D-Glu D-Asn |
3.5 13.4 2 13.1 |
|
Vino bianco |
D-Ala |
3.3 |
|
Pomodori |
D-Asp D-Ala D-Glu D-Asn |
0.4 0.3 0.2 0.5 |
|
Balsamico |
D-Asp D-Ala D-Glu D-Arg |
5.7 3.4 2.4 0.7 |
|
Caffè Istantaneo |
D-Asp D-Glu D-Pro |
43 27.4 14.4 |
|
Tostato |
D-Asp D-Glu D-Phe |
23-38 32-41 9-12 |
|
Verde |
D-Glu |
<0.2 |
|
Prosciutto/carne Hamburger crudo |
D-Asp D-Phe D-Ala D-Leu D-Val |
6.2 2.8 3.2 3.1 1.6 |
|
Hamburger cotto |
D-Asp D-Phe D-Ala D-Leu D-Val |
5.5 2.7 2.8 3.2 1.5 |
|
Prosciutto di Parma |
D-Asp D-Glu D-Ala D-Leu D-Val D-Ile D-Pro D-Lys |
5.0 10.8 9.1 7.6 10.9 5.9 4.9 14.6 |
|
Prosciutto prima della cottura |
D-Asp D-Phe D-Glu D-Ala |
0.03 0.5 1.0 0.2 |
|
Prosciutto, cotto a 180°C |
D-Asp D-Phe D-Ala D-Leu D-Val |
10.7 3.1 2.4 3.1 1.6 |
|
Altri prodotti Fagioli neri fermentati |
D-Asp D-Ala D-Pro |
7.8 10.6 4.9 |
|
Condimenti pronti a base di spezie |
D-Asp D-Phe D-Glu D-Ala D-Leu D-Val D-Pro D-Ser |
6.9 3.7 3.0 2.7 10.0 1.5 2.0 1.4 |
|
Toast, abbrustolito |
D-Asp D-Phe D-Ala D-Leu D-Val |
10.5 2.4 2.8 2.7 1.1 |
|
Toast, non trattato |
D-Asp D-Phe D-Ala D-Leu D-Val |
5.6 2.3 2.4 3.2 0.9 |
D-amino acidi generati da processi tecnologici
La disponibilità di alimenti preparati industrialmente che contengono elevate quantità di D-AA sta aumentando sempre più (ad es. patate al forno, succhi e polpa di frutta, cereali per la colazione, polpa di pomodoro, latte, ecc.). I principali fattori che influenzano la racemizzazione sono valori alcalini di pH, la durata del trattamento, l’eccessivo riscaldamento e la relativa durata (spesso troppo lunga) [Genchi, 2017].
Il latte, la carne e alcuni succhi di frutta, che normalmente contengono basse quantità di D-AA, spesso vengono sottoposti, durante la preparazione per renderli idonei al consumo, a condizioni che favoriscono la racemizzazione. In particolare il latte e i latticini sono degli ottimi esempi di come la naturale composizione di alcuni cibi possa essere alterata dai processi industriali. Un’indagine condotta sul contenuto in amino acidi del latte ha evidenziato l‘assenza di racemizzazione in campioni esposti ad elevate temperature ma per un breve tempo (come la pastorizzazione e i processi ultra-high temperature UHT), mentre alti livelli di D-AA sono stati riscontrati nel latte sterilizzato o in polvere, come risultato dei processi tecnologici a cui è stata sottoposta la materia prima [Gandolfi, 1994]. In questi casi è stato osservato un incremento nel contenuto di D-Ala da un minimo del 3-4% (concentrazione di riferimento considerata fisiologica) fino ad un massimo del 12%. La D-metionina (D-Met) può essere modificata chimicamente durante i trattamenti e L-fenilalanina (L-Phe) e L-tirosina (L-Tyr) vengono trasformate rapidamente nei corrispondenti D-enantiomeri in seguito a trattamento con alcali ad elevate temperature [Csapò et al., 2008]. La Figura 4 dell’articolo di [Friedman, 1999] riporta l’effetto della temperatura sul contenuto di D-serina (D-Ser) e D-treonina (D-Thr) nelle proteine della soia, e in Tabella 2 dello stesso lavoro la composizione delle proteine trattate con alcali.
Per questo motivo, la presenza di D-AA nei cibi può essere utilizzata come biomarcatore di trattamenti termici spinti o trattamenti alcalini.
Presenza dei D-amino acidi negli alimenti fermentati
Negli alimenti fermentati, la presenza di D-AA può essere considerata “naturale”. Qui la loro formazione può derivare dalla materia prima oppure può essere dovuta all’attività microbica durante i processi fermentativi. Elevati livelli di D-Ala, D-Asp and D-Glu sono spesso presenti nei formaggi, nello yogurt, nel vino, nell’aceto, nella birra, nel sake, nella salsa di soia, etc. Nel vino, birra e aceto, la presenza della D-prolina (D-Pro) è utilizzata come indicatore dell’invecchiamento [Chiavaro et al., 1998]. L’impiego di batteri lattici e lieviti nella lievitazione prima della cottura porta alla produzione di D-Ala e D-Glu [Gobbetti et al., 1994]. Il miele e i condimenti pronti a base di spezie presentano un contenuto variabile in D-AA liberi [Pawloska and Armstrong, 1994; Friedman, 1999]. Elevati livelli di D-Ala, D-Asp e D-Glu sono presenti anche nei formaggi a lunga stagionatura come il Parmigiano Reggiano e il Grana Padano (fino a 5 g/kg). La quantità di D-amino acidi è differente a seconda del tipo di formaggio e cambia durante la produzione e la maturazione [Marchelli et al., 1997; Innocente and Palla, 1999; Marchelli et al., 2007].
I D-amino acidi come indice di contaminazione (in alimenti non fermentati)
Gli amino acidi D-Ala, D-aspartico (D-Asp), D-arginina (D-Arg) e D-glutammico (D-Glu) sono presenti in basse quantità in alcuni frutti come mele, uva e arance, ma anche in alcune verdure come carote, pomodori, cavoli e nei rispettivi succhi [Gandolfi, 1994]. La presenza di specifici D-AA (e la loro concentrazione) può essere utilizzata per verificare la purezza dei succhi, escludendo la contaminazione da altri frutti (ma anche l’adulterazione o l’arricchimento dei prodotti) [Gandolfi, 1994]. Inoltre, la concentrazione di questi D-AA può essere impiegata come indicatore di contaminazione batterica o di scarsa qualità della materia prima utilizzata per la preparazione dei succhi di frutta [Gandolfi, 1994].
Il gusto dei D-amino acidi
I D-AA sono molto più dolci dei rispettivi L-enantiomeri, generalmente più amari. In alcuni casi, il potere dolcificante della D-valina (D-Val), D-fenilalanina (D-Phe) e D-triptofano (D-Trp) è maggiore rispetto a quello del saccarosio [Linden and Lorient 1999]. L’Alitame (l-α-aspartil-N-(2,2,4,4-tetrametil-3-tioetanil)-d-alaninammide) (Figura 1), un dipeptide artificiale contenente L-Asp and D-Ala, è interessante da un punto di vista commerciale poiché è circa 2000 più dolce del saccarosio, circa 10 volte più dolce dell’aspartame, e 6 volte più dolce della saccarina [Chattopahyay et al., 2014].

Figura 1: Formula dell’Alitame
Sono i D-amino acidi buoni per la salute umana?
L’effetto del metabolismo dei D-AA negli esseri umani è ancora controverso. Nei mammiferi la degradazione dei D-AA avviene tramite deaminazione ossidativa a chetoacidi, catalizzata dall’enzima D-amino acido ossidasi e successiva transaminazione a L-amino acidi. Non è ancora chiaro se l’organismo umano sia capace di utilizzare completamente i D-AA, sebbene la D-amino acido ossidasi sia presente in fegato e reni. Infatti, le reazioni di racemizzazione interessano solo specifici amino acidi (soprattutto la D-serina) e tessuti selezionati. Nei mammiferi, il contributo più significativo al metabolismo dei D-AA viene fornito dal microbiota.
E’ stato riportato come livelli alterati di D-AA inducano seri danni soprattutto a carico dei reni; cambiamenti nella concentrazione dei D-AA in tessuti e nel sangue sono stati collegati a diversi stati patologici, permettendo così l’identificazione di biomarcatori innovativi e potenzialmente migliori (vedere la sezione “D-AA nelle malattie”) [Marchelli et al., 2007].Inoltre, è in studio l’uso della D-Ser come supplemento nei trattamenti per la cura della schizofrenia [MacKay et al., 2019]. Il valore nutrizionale dei D-AA è stato ampiamente analizzato in topi sottoposti a dieta a base di soli amino acidi sintetici [Friedman and Levin, 2012]. L’effetto biologico dei D-AA è differente a seconda che essi vengano ingeriti come amino acidi liberi oppure come componenti di proteine. Il potere nutrizionale dei D-AA essenziali dipende dalla composizione, dalla loro digeribilità e utilizzazione in seguito alla degradazione delle proteine. In effetti, legami peptidici con configurazioni D-L, L-D o D-D sono resistenti agli enzimi proteolitici con conseguente minore digeribilità ed eventuale formazione di oligopeptidi ad attività biologica sconosciuta. Non sono stati osservati effetti tossici in trials condotti su adulti e giovani alimentati per via parenterale con una miscela di D,L-AA liberi [Marchelli et al., 2007]. Considerando i singoli D-AA, la D-Met è poco utilizzata dagli esseri umani quando consumata oralmente o nella nutrizione parenterale, la D-Tyr può diminuire significativamente la crescita nei topi, così come D-Met e D-Lys [Friedman and Levin, 2012]. Alla luce di quanto detto, i D-AA possono essere utili nel controllo del peso corporeo grazie al loro specifico valore di sostituzione (ovvero alla concentrazione relativa del corrispondente L-amino acido).
Il gruppo Shiseido ha scoperto che i livelli di D-Asp diminuiscono con l’età, e di conseguenza diminuisce anche la produzione di collagene. Dopo un trial in cui per 2 mesi è stato assunto D-Asp, lo spessore della pelle risultava decisamente incrementato. Grazie a questi risultati, è stato prodotto il primo “functional food” arricchito in D-AA chiamato “kireinosusume” [Mutaguchi et al., 2016].
Referenze bibliografiche
Chattopadhyay et al. 2014 J. Food. Sci. Technol. 51: 611–621.
Chiavaro et al. 1998 It J Food Sci 10(4): 329-337
Csapò J. et al., 2008 Amino Acids 34(2): 287-292
Friedman M. 1999 J Agr Food Chem 47(9): 3457-3479
Friedman M. and Levin C.E. 2012 Amino Acids 42: 1553-1582
Genchi G. 2017 Amino Acids 49(9): 1521-1533
Gandolfi et al., 1994 J Food Sci 59: 152–154
Gobbetti et al., 1994 J Food Sci 59: 881-884
Innocente N. and Palla G., 1999 J Dairy Res 66: 633-637
Linden G. and Lorient D. 1999 In: New Ingredients in Food Processing: Biochemistry and Agriculture. G. Linden and D. Lorient, ed. CRC Press, pp 184–210
MacKay M.B. et al., 2019 Front Psychiatry 10:25
Marchelli R. et al., 1997 Sc Tecn Latt-Cas 48: 21-32
Marchelli R. et al., 2007 In: D-amino acids: a new frontier in amino acid and protein research. Editors: R. Konno et al., pp 299-315
Mutaguchi Y. et al., 2016 In: D-amino acids. Editors: T. Yoshimura et al., pp 341-357
Pawloska M. and Armstrong D. W., 1994 Chirality 6: 270-276
Zagon J. et al., 1994 Nutr Res 14(3): 445-463
Autori
Giorgia Letizia Marcone – University of Insubria
Elena Crespi – FIIRV (DAAIR Center)
